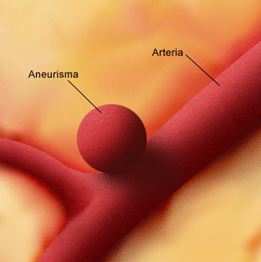
Aneurisma intracraneal
Aunque se suele utilizar el término aneurisma cerebral, éste es un término mal empleado ya que no debería incluir a los aneurismas de la fosa posterior.
Intracraneal se refiere a todos los aneurismas tanto de fosa anterior media y posterior.
Historia
Aunque la primera descripción se atribuye en el siglo XVIII a Giovanni Battista Morgagni y a Francisco Biumi, su explicación sobre esta patología no es del todo convincente 1).
La primera descripción clínica de la ruptura de un aneurisma fue por Blackwell, en 1813, en una mujer de 20 años de edad en quien la autopsia reveló un aneurisma de la arteria basilar en su bifurcación.
En la segunda mitad del siglo XlX e inicios del siglo XX, la descripción clínica detallada se tornó más frecuente, incluyendo contribuciones notables por Gull, Bartholow, Beadles, y Fearnsides.
Se adquiere un mayor conocimiento de este tema a partir de las publicaciones de Sir Charles Symonds, quien estableció a la hemorragia subaracnoidea (HSA) como una entidad clínica distinta y muy importante.
Después de la introducción por Egas Moniz, en 1927 de la angiografía la confirmación exacta de la sospecha clínica de un aneurisma roto se convirtió en una realidad.
La primera cirugía electiva para un aneurisma sacular intracraneal fue realizada en 1933 por Dott. Utilizó un fragmento de músculo para envolver un aneurisma que se rompió trans-operatoriamente, logrando detener con éxito el sangrado y resultando en un buen resultado clínico.
Walter Dandy estableció el principio quirúrgico de la obliteración directa del cuello del aneurisma como el tratamiento ideal para combatir esta patología cuando colocó un clip de plata a través del cuello de un aneurisma de la arteria carótida interna en el origen de la arteria comunicante posterior el 23 de marzo del año 1937.
Clasificación
Según morfología
Los aneurismas intracraneales son divididos en tres tipos básicos:
Aneurisma sacular, que a su vez pueden ser de cuello normal, estrecho o ancho
Según localización
Aneurisma de la arteria comunicante anterior
Aneurisma de la arteria comunicante posterior
Aneurisma de la arteria basilar
Aneurisma de la arteria carótida interna
Aneurisma de la arteria cerebral anterior
Aneurisma de la arteria cerebral media
Aneurisma de la arteria cerebral posterior
Aneurisma de la arteria hipofisaria superior
Aneurisma de la arteria oftálmica
Según su relación con estructuras vecinas
Aneurisma paraclinoideo
Aneurisma intraselar
Según el cuello
De cuello ancho……
Según su aparición
Recurrente, residual , de nueva formación…..
Según su morfología
Saculares, fusiformes…
Complejos….
Según su relación con estructuras vecinas
Con efecto masa….
Paraclinoideos…..
Según su hallazgo
Según su tamaño
Según su resultado tras el tratamiento
Recanalizados, compactados…
Según la cantidad
Único
Múltiples
La localización más frecuente de los aneurismas cerebrales es en las arterias de la base del cerebro, conocido como “círculo polígono de Willis”.
El 85 % de los aneurismas cerebrales se desarrollan en la porción anterior del polígono de Willis y afectan la arteria carótida interna y sus ramas intracraneales.
La localización más frecuente incluye el complejo de la arteria comunicante anterior (39-35 %), el origen de la arteria comunicante posterior a partir de la arteria carótida interna (39-35 %), la bifurcación de la arteria cerebral media (20 %), la bifurcación de la arteria basilar y el resto de las arterias de la circulación posterior (5 %). Pueden ser solitarios (70 % a 75 %) o lesiones vasculares múltiples (25 % a 30 %), usualmente localizados en el polígono de Willis.
Clasificación por etiología
Aneurismas espontáneos
La mayoría de los aneurismas intracraneales son verdaderos aneurismas que contienen todas las capas o componentes de la pared vascular normal. En contraste, en los aneurismas falsos o pseudo-aneurismas la luz del vaso no crece, aun cuando el diámetro externo del segmento anormal puede estar incrementado. Estos aneurismas son poco frecuentes dentro del cráneo.
Algunos factores externos como el tabaquismo, el consumo intenso de alcohol, y el uso de anticoagulantes y anticonceptivos parecen estar relacionados con la formación de este tipo de aneurismas.
La causa más frecuente para el desarrollo de un aneurisma son lesiones vasculares inducidas hemodinámicamente, ateroesclerosis, vasculopatia subyacente y estados de alto flujo. Causas menos comunes son trauma, infección, abuso de drogas y neoplasias.
Los aneurismas intracraneales no caen precisamente en la categoría de verdaderas malformaciones vasculares; usualmente son adquiridos. La mayoría de los aneurismas cerebrales resultan de una anormalidad (debilidad ) innata en la pared de la arteria. Los aneurismas cerebrales son también más frecuentes en personas con ciertas anomalías genéticas, como las enfermedad de la colágena o enfermedad de riñones poliquisticos y en ciertos trastornos circulatorios como las malformaciones arteriovenosas (MAV´s).
Otras causas incluyen: Hipertensión arterial, trauma craneal, lesiones penetrantes craneales, infecciones, tumores, ateroesclerosis, y otras enfermedades vasculares, uso de drogas (Ej. cocaína y el tabaquismo). Algunos investigadores especulan que el uso de anticonceptivos orales incrementa el riesgo para el desarrollo de un aneurisma.
Aneurismas micóticos
Los aneurismas que resultan de la infección en la pared de una arteria son llamados aneurismas micóticos.
Aneurismas traumáticos
Son considerados con una frecuencia menor al 1%. Por lo general se trata de pseudoaneurismas ya que parte de su estructura es tejido cerebral. Se ven asociados a trauma penetrante de cráneo (por objeto punzo-cortante o por proyectil de arma de fuego); pero también pueden verse en traumatismo craneal cerrado. En este último es más común y se puede producir lesión de porción proximal de vaso principal como la arteria carótida en su porción petrosa o cavernosa o puede ocurrir en arterias distales corticales que sufren trauma por fractura craneal deprimida.
Según la ruptura
Aneurismas no rotos
El porqué las mujeres y los pacientes con aneurismas de más de 5 mm o aneurismas de circulación posterior tienen un mayor riesgo de ruptura aún no se ha resuelto (Vlak y col., 2011).
Epidemiología
La prevalencia de los aneurismas intracraneales en EE.UU. se estima entre 1% y 6%, con 27.000 casos anuales de ruptura causante de hemorragia subaracnoidea (Rinkel y col., 1998).
Los pacientes con enfermedad autosómica dominante con riñón poliquístico presentan un aneurisma cerebral en el 13.6% de los casos (Magistroni y col., 2011).
La mayoría de estas lesiones son clínicamente silentes, su ruptura, por lo general ocurre entre los 40 y 60 años sin previo aviso (International Study of Unruptured Intracranial Aneurysms Investigators, 1998; Bederson y col., 2000).
Los aneurismas cerebrales son poco frecuentes en niños y casi nunca ocurren en neonatos. Si un neonato o niño pequeño sufre una hemorragia aneurismática, usualmente se trata de una enfermedad de los tejidos conectivos como causa subyacente.
Etiología
La opinión más extendida es que la enfermedad aneurismática cerebral está relacionada con factores hemodinámicos y genéticos, asociados con la debilidad estructural de la pared arterial que fue adquirido por un evento particular, a menudo desconocido.
Posiblemente el momento de activación de la formación del aneurisma depende de la dinámica de crecimiento arterial, que está estrechamente relacionado con el envejecimiento / la aterosclerosis.
La posibilidad se incrementa por una historia familiar de aneurismas, y entre ciertas poblaciones como Japón y Finlandia .
Otros factores de riesgo documentados, incluyen la hipertensión , el tabaquismo , el consumo de alcohol y el sexo femenino.
El estrógeno protege varios componentes dentro de la pared de la arteria , e inhibe algunas de las moléculas inflamatorias que podrían causar que los aneurismas . En la menopausia, el nivel de estrógeno disminuye y aumenta la incidencia de aneurisma .
Las tensiones hemodinámicas se han demostrado estar involucrados en la formación , el crecimiento y la rotura de los aneurismas . Esto a menudo se asocia con la hipertensión , lo que también aumenta el riesgo de rotura del aneurisma 2)
Hay varias condiciones hereditarias asociadas como la enfermedad renal poliquística autosómica dominante, la neurofibromatosis tipo I, síndrome de Marfan, neoplasia endocrina múltiple tipo I, pseudoxantoma elástico, telangiectasia hemorrágica hereditaria y síndrome de Ehlers-Danlos tipo II y IV.
Recientes hallazgos experimentales han sugerido que el mecanismo de formación se basa en la inflamación crónica en las paredes arteriales por la fuerza hemodinámica.
La óxido nítrico sintasa endotelial (eNOS) protege las paredes arteriales de la inflamación vascular por el alivio de la fuerza hemodinámica a través de óxido nítrico (NO)(Aoki et al 2011).
La hipertensión arterial, tabaquismo y el alcoholismo contribuyen al engrosamiento de la capa íntima en la pared arterial, en los sitios de ramificación proximal y distal. Esta es la etapa más temprana de la formación de los aneurismas. Dentro de estos cojinetes, la capa íntima no es elástica, por lo que ocasiona una tensión elevada sobre as porciones mas elásticas de la pared del vaso. Anormalidades en las proteínas de la matriz extracelular contribuyen adicionalmente a la formación del aneurisma. La teoría popular de un defecto congénito en la túnica media de la capa muscular es como un punto débil a través del cual la capa interna de la pared arterial protruira, genera dudas debido a varias observaciones contradictorias. Hendiduras en la capa muscular están igualmente presentes en pacientes con y sin aneurismas. Si un aneurisma se ha formado, el defecto en la pared muscular no está localizado en el cuello, sino en la pared del saco aneurismático.
Etiopatogenia
La teoría patogénica más probable es que los aneurismas son adquiridos debido a cargas de tensión hemodinámica sobre las bifurcaciones arteriales que no tienen soporte. Este señalamiento, es respaldado por la observación clínica de que muchos pacientes con aneurismas de ACoA tienen ausente o hipoplasico el segmento A1 y por lo tanto tienen una carga hemodinámica elevada en el complejo de ACoA.
Aparte de los factores de riesgo bien establecidos, como la hipertensión arterial, el tabaquismo, sexo femenino, hay evidencia de una significativa contribución genética.
Genética
La asociación más fuerte se encuentra en la región 9p21.3 (CDKN2A / CDKN2B), asociado con un alelo de la enfermedad coronaria.
El descrito previamente en región 8q11.2-P12.1 (SOX17 locus) tiene dos señales independientes: el 3'-SOX17 y la región 5'-SOX17.
18q11.2(RBBP8),en estrecha relación con el gen RBBP8 que codifica el retinoblastoma, está implicada en el ciclo celular mediante la interacción con el BRCA1.
10q24.32 (CNNM2), y asigna un intrón que codifica la ciclina M2 (intrón 1 del CNNM2).
13q13.1 (KL/STARD13), en el intrón 7 del gen que codifica lípidos StAR relacionados con la transferencia de dominio (START13),y contiene dos SNPs significativamente asociadas con el aneurisma.
Otros factores:
4q31.23, 12q22 y 20p12.1 (Yasuno y col., 2011).
La detección de aneurismas familiares puede estar justificada, cuando existen 2 familiares de primer grado con historia de hemorragia subaracnoidea o gemelos monocigóticos (Korja y col., 2010).
Fisiopatología
La fisiopatología exacta del desarrollo y la ruptura de los aneurismas saculares es controvertida.
Existen varias líneas de evidencia que indican un papel de los procesos inflamatorios. Del mismo modo, la angiogénesis anormal podría estar relacionado con el crecimiento del aneurisma, ya que la expresión de factores de angiogénesis es mayor en los pacientes portadores de aneurismas.
La VEGF no es un factor de riesgo genético importante para la hemorragia subaracnoidea por aneurisma 3)
Diagnóstico
Tanto la angiografía por tomografía computarizada como la angiografía por sustracción digital se utilizan para detectar aneurismas en pacientes con hemorragia subaracnoidea.
En un estudio en 116 hospitales entre el 2006-2011 sobre 4972 pacientes (1022 clipados, 3950 embolizados).
El porcentaje de pacientes con angio-TC aumentó significativamente entre un 20% en el 2006 a un 44% en el 2011 (p <0,0001), mientras que el porcentaje de pacientes que se diagnosticaron mediante angiografía se mantuvo sin cambios (96 a 94%).
Esta tendencia se ha observado tanto para pacientes con embolización (de 17 a 42%) y los pacientes clipados (32 a 54%).
Hubo un aumento significativo en el porcentaje de pacientes con control de imágen tras el tratamiento (del 41% en 2006 al 48% en 2011). Esta tendencia se observó en los pacientes clipados (33 a 65%), pero no en los pacientes embolizados (43 a 45%).
Por lo que se puede concluir que existe un incremento del uso de la angio-TC desde el 2006 al 2011 sin una disminución correspondiente en el uso de la angiografía. Estos resultados plantean la cuestión de la redundancia potencial sin valor añadido clínico de la segunda prueba (McDonald y col.,2013).
Hasta ahora, no hay pruebas de diagnóstico de factores de riesgo genéticos específicos para identificar a los pacientes que están en un alto riesgo de desarrollar aneurismas intracraneales. El conocimiento de los determinantes genéticos puede ser útil con el fin de obtener pistas en la detención de la formación de aneurisma y obtener herramientas de diagnóstico para la identificación de individuos con mayor riesgo 4)
Tratamiento
Los métodos de tratamiento incluyen dos opciones de intervención principales:
1.- Tratamiento endovascular con coils, embolización con coils asistidos por stents o stents diversificadores de flujo.
2.- Cirugía a través craneotomía para colocar un clip en el cuello del aneurisma.
En contraste a la cirugía, la embolización endovascular no requiere de cirugía abierta. En su lugar el cirujano emplea tecnología de rayos-x en tiempo real, llamada imagen de fluoroscopia, para visualizar el sistema vascular del paciente y tratar desde el interior de la arteria, el aneurisma. Después de lograr acceso a la circulación arterial por medio de una punción femoral, radial o carotidea directa empleando la técnica de Seldinger. Se efectúa cateterismo superselectivo para lograr acceso al interior del aneurisma y se colocan Coils de diversos tamaños para excluir el aneurisma de la circulación.
Más de 125,000 pacientes se han tratado en el mundo por medio de embolización con coils desprendibles.
Embolización utilizando Onyx:
Aneurismas de Cuello Ancho:
Tratamiento de Aneurismas de Cuello ancho asistido con Balón (remodelación):
Tratamiento de Aneurismas de Cuello ancho asistido con Stent:
Tratamiento de Aneurismas Gigantes
El paciente con un aneurisma gigante (mayor de 25 mm) puede presentarse con hemorragia subaracnoidea, efecto de masa o con isquemia debido a embolismo a partir de trombos en el interior del aneurisma hacia la circulación arterial distal, o pueden incluso ser hallazgos incidentales. Constituyen el 5 % del total de los aneurismas intracraneales. Estos aneurismas son lesiones que ponen en peligro la vida. Se ha reportado una mortalidad de hasta el 85 % en los primeros dos años después de la ruptura de un aneurisma gigante. Los supervivientes frecuentemente tienen discapacidad severa. Este tipo de aneurismas constituyen un reto formidable para el equipo de neurocirugía vascular y/o endovascular.
Micro-Cirugía:
El tratamiento ideal es el clipado del cuello del aneurisma preservando el flujo arterial en la arteria que origino al aneurisma y con exclusión del aneurisma de la circulación arterial. Este método disminuye el volumen del aneurisma y su efecto de masa. Sin embargo, con frecuencia es imposible la oclusión del aneurisma debido al cuello ancho, ramas arteriales originándose del domo del aneurisma, acceso quirúrgico complejo o vulnerabilidad del aneurisma.
Terapia Endovascular: Otra forma de tratamiento es por la vía endovascular. El abordaje endovascular tradicional para el manejo de estos aneurismas es la oclusión de la arteria principal empleando balones desprendibles. Con esta técnica se presentan complicaciones isquémicas hasta en un 5 a 10 % de los pacientes a pesar de contar con una prueba de oclusión con balón bien tolerada. La oclusión del aneurisma con coils ha probado ser superior que el clipado del cuello en términos de supervivencia a un año. Sin embarco la oclusión del aneurisma con coils se logra únicamente entre el 10 al 68 % de los pacientes. utilizando stents cubiertos Willis. Se considera que el paciente que se presenta con efecto de masa compresiva debido a un aneurisma gigante es el candidato ideal para el tratamiento con stents cubiertos. Sin embargo, las complicaciones potenciales deben considerarse cuidadosamente antes de realizar el procedimiento endovascular.
En aquellos pacientes con aneurismas gigantes intracraneales de la arteria cerebral media que no pueden ser clipados por via micro-quirugica o embolizados por vía endovascular el puenteo del flujo arterial utilizando la técnica de ELANA ha brindado resultados satisfactorios.
Tratamiento endovascular
Los agentes líquidos embólicos también parecen estar asociados con una menor probabilidad de recanalización y menor costo en comparación con los coils (Reig 2009). Los stents se asocian con una disminución significativa de las recurrencias angiográficas, pero se asocia con complicaciones más letales en comparación con los coils sin colocación de stents (Piotin 2009).
La embolización es una alternativa al clipaje.
No existe una clara recomendación sobre qué tratamiento es más eficaz, y este depende de las características del paciente, de su estado clínico, de la comorbilidad, de las características del aneurisma a tratar y, sobre todo, de la experiencia del equipo constituido por neurocirujano e intervencionista del centro 5).
Existe controversia acerca de la mejor estrategia terapéutica en pacientes con aneurismas rotos, y hay una gran variabilidad de centro-país, relacionada con las tasas de clipaje frente a embolización. En un meta-análisis de ensayos controlados prospectivos en aneurismas rotos extrayendo la proporción de pacientes con un mal pronóstico a 1 año y episodios de resangrado del aneurisma tratado, se encontraron 3 ensayos prospectivos controlados para su inclusión. Estos estudios incluyeron 2723 pacientes.
El índice de mal pronóstico a 1 año fue significativamente menor en los pacientes asignados a la embolización con coils (razón de riesgo, 0,75, 95% intervalo de confianza, 0.65-0.87). Este efecto relativo es consistente con una reducción del riesgo absoluto del 7,8% y un número necesario a tratar de 13 años. El efecto sobre la mortalidad no fue estadísticamente diferente entre los 2 tratamientos.
Las tasas de nuevas hemorragias en el primer mes fueron mayores en los pacientes asignados a embolizaciones, por lo que en base al análisis de los 3 ensayos de alta calidad disponibles prospectivos controlados, hay pruebas contundentes de que la embolización endovascular mediante coils se asocia con mejores resultados en comparación con el clipaje quirúrgico en pacientes susceptibles a las dos estrategias terapéuticas (Lanzino y col., 2013).
La embolización endovascular, se ha convertido en un tratamiento ampliamente aceptado como alternativa a la oclusión mediante clipaje, tras los resultados del ISAT publicados en el 2002 6).
Otro enfoque merecen los aneurismas no rotos.
Los resultados en cuanto a morbimortalidad obtenidos mediante tratamiento quirúrgico o embolizador no son diferentes. La estabilidad del tratamiento quirúrgico es superior al del endovascular, con mayores tasas de oclusión y menor necesidad de retratamiento. El tratamiento endovascular resulta más caro que el quirúrgico en aneurismas rotos, fundamentalmente debido al precio de los materiales de embolización, a la tasa de retratamientos y al seguimiento que precisan. Estas diferencias podrían ser aún más significativas en el caso de aneurismas no rotos, en los que se presupone un ingreso hospitalario menor, fuente principal del gasto en el tratamiento quirúrgico de esta patología 7).
Complicaciones
Bibliografía
Lanzino, G, M H Murad, P I d’ Urso, and A A Rabinstein. 2013. “Coil Embolization Versus Clipping for Ruptured Intracranial Aneurysms: A Meta-Analysis of Prospective Controlled Published Studies.” AJNR. American Journal of Neuroradiology (April 11). doi:10.3174/ajnr.A3515.
McDonald, J S, D F Kallmes, G Lanzino, and H J Cloft. 2013. “Use of CT Angiography and Digital Subtraction Angiography in Patients with Ruptured Cerebral Aneurysm: Evaluation of a Large Multihospital Data Base.” AJNR. American Journal of Neuroradiology (April 11). doi:10.3174/ajnr.A3478.
Vlak, Monique H M, Gabriel J E Rinkel, Paut Greebe, and Ale Algra. 2013. “Risk of Rupture of an Intracranial Aneurysm Based on Patient Characteristics: A Case-Control Study.” Stroke; a Journal of Cerebral Circulation (March 21). doi:10.1161/STROKEAHA.111.000679.
Aoki, Tomohiro, Masaki Nishimura, Hiroharu Kataoka, Ryota Ishibashi, Kazuhiko Nozaki, y Susumu Miyamoto. 2011. Complementary inhibition of cerebral aneurysm formation by eNOS and nNOS. Laboratory Investigation; a Journal of Technical Methods and Pathology (Febrero 14). doi:10.1038/labinvest.2010.204. http://www.ncbi.nlm.nih.gov/pubmed/21321533.
Bederson JB, et al. (2000) Recommendations for the management of patients with unruptured intracranial aneurysms: A Statement for healthcare professionals from the Stroke Council of the American Heart Association. Stroke 31:2742–2750
International Study of Unruptured Intracranial Aneurysms Investigators (1998) Unruptured intracranial aneurysms—Risk of rupture and risks of surgical intervention.N Engl J Med 339:1725–1733.
Korja M, Silventoinen K, McCarron P, et al. Genetic epidemiology of spontaneous subarachnoid hemorrhage: Nordic Twin Study. Stroke 2010;41:2458-62
Magistroni, Riccardo, Lucia Palmieri, and Francesco Scolari. 2011. “[Screening for cerebral aneurysms in the ADPKD population: mandatory or potentially harmful?].” Giornale Italiano Di Nefrologia: Organo Ufficiale Della Società Italiana Di Nefrologia 28 (6) (December): 582-587.
Piotin M, Blanc R, Spelle L, Mounayer C, Piantino R, Schmidt PJ, Moret J. Stent-Assisted Coiling of Intracranial Aneurysms. Clinical and Angiographic Results in 216 Consecutive Aneurysms. Stroke. 2009 Dec 3.
Reig AS, Simon S, Mericle RA. Embolization of a giant pediatric,posttraumatic, skull base internal carotid artery aneurysm with a liquid embolic agent. J Neurosurg Pediatr. 2009 Nov;4(5):449-52.
Rinkel GJ, Djibuti M, Algra A, van Gijn J (1998) Prevalence and risk of rupture of intracranial aneurysms: a systematic review. Stroke 29:251–256.
Vlak, Monique H M, Gabriel J E Rinkel, Paut Greebe, Johanna G van der Bom, and Ale Algra. 2011. “Trigger factors for rupture of intracranial aneurysms in relation to patient and aneurysm characteristics.” Journal of Neurology (December 21). doi:10.1007/s00415-011-6341-1. http://www.ncbi.nlm.nih.gov/pubmed/22186848.
Yasuno, Katsuhito, Mehmet Bakircioglu, Siew-Kee Low, Kaya Bilgüvar, Emília Gaál, Ynte M Ruigrok, Mika Niemelä, et al. 2011. “Common variant near the endothelin receptor type A (EDNRA) gene is associated with intracranial aneurysm risk.” Proceedings of the National Academy of Sciences of the United States of America (November 21). doi:10.1073/pnas.1117137108. http://www.ncbi.nlm.nih.gov/pubmed/22106312.
Libros recomendados
Anamnesis
Motivo de ingreso
Paciente de xx años, que ingresa de forma urgente procedente del Hospital xxxxx por hemorragia subaracnoidea.
Antecedentes
Apendicectomía Diabetes no insulino dependiente No alergias conocidas.
Enfermedad actual
Presenta el 13 de Agosto a las 9:30 mientras desayunaba cefalea intensa de aparición brusca hemicraneal izquierda. Ingresa en el Hospital xxxxx a las 10:30 consciente, orientado sin déficit neurológico con leve rigidez de nuca Escala de Hunt y Hess 1 Escala WFNS 1.
Exploración neurológica
Consciente, orientado sin déficit neurológico con leve rigidez de nuca Hunt y Hess 1 WFNS 1
Pruebas complementarias
En TAC cerebral del 13 de agosto a las 11:15: Hemorragia subaracnoidea difusa fina, < 1 mm en cisternas verticales. Escala de Fisher grado 1.
En angiografía cerebral del 13 de Agosto a las 13:00 aneurisma de la arteria comunicante anterior sacular de 5 mm. de dirección ánterosuperior que se emboliza.
Evolución
Ingresa en la UCI sin complicaciones. Consciente, orientado sin déficit neurológico con leve rigidez de nuca.
El 15 de agosto se realiza TAC cerebral que no presenta cambios con respecto al TAC previo, sin signos de hidrocefalia por lo que tras evolución ingresa en la planta de Neurocirugía consciente, orientado.
El 17 de agosto se practica Doppler transcraneal sin signos de vasoespasmo.
Analítica de sangre del 18 de agosto sin alteraciones.
El 18 de agosto el paciente está consciente, orientado sin focalidad neurológica, Dieta basal, sin dolor,sin trastornos del sueño,Afebril constantes mantenidas.
Se solicita traslado a su hospital de origen.
Hoja operatoria
Bajo anestesia general, intubación orotraqueal y profilaxis antibiótica con cefazolina 2 gr IV.
Colocación del paciente en decúbito supino sobre cabezal de Mayfield® en posición lateralizada a 30 º izquierda.
Antisepsia cutánea con Povidona yodada al 10 %.
Disección hasta exponer el área para la craneotomía.
Craneotomía frontotemporal, con ayuda de 2 trépanos
Apertura dural curvilinea pediculada a pterion.
Se diseca proximalmente la cisterna óptico carotídea, comunicante, coroidea y tronco de la arteria cerebral anterior y media