Aneurisma de la arteria comunicante anterior
Historia
La primera publicación en MEDLINE es la de Fouché, C.H., 1931. Aneurysm of the Anterior Communicating Artery of the Brain. Proceedings of the Royal Society of Medicine, 24(11), págs.1471-1472, basado en un estudio postmortem.
En 1936 Tönnis publicó el primer tratamiento exitoso de un aneurisma de la arteria comunicante anterior (Tönnis, 1936).
Dandy en 1942.
En 1953 Norlén y Barnum fueron los primeros en publicar una serie de aneurismas de esta localización.
En 1954 Huber y Stearns publican una vía bifrontal con hipotensión.
En 1959 Krayenbühl publicó una monografía.
Hasta cerca de 1950 el tratamiento de elección fue por lo general la ligadura de la arteria carótida en el cuello, que se siguió recomendando hasta los finales de los 60 cuando un segmento de la A1 fuera hipoplásica. Aún en los 70 algunos neurocirujanos favorecieron este tipo de tratamiento, aunque también en esta década comenzó el wrapping, trombosis estereotáctica y oclusión con balón.
La introducción del microscopio quirúrgico abrió una nueva etapa.
Epidemiología
Es el lugar más frecuente de aneurisma intracraneal, representando entre el 30-37 %, de todos los aneurismas intracraneales.
En la revisión de Hernesniemi sobre 921 aneurismas de la ACoA, el 80% presentaron ruptura con un diámetro medio de 7 mm.
Etiopatogenia
La asimetría del segmento proximal de la arteria cerebral anterior se asocia con una alta incidencia (Andrews 1981).
La configuración asimétrica del circulo de Willis, se ha correlacionado como factor etiopatogénico de aneurismas principalmente en el origen de la comunicante anterior.En un estudio autópsico en población china se encontró asimetría de los segmentos A1, con una frecuencia de 13.30% y en un caso se asoció a lesión aneurismática de la arteria comunicante anterior; en la población española se encontró aneurismas en esta localización en el 71% de casos donde se estableció dominancia de flujo evaluada por estudio hemodinámico, mientras que en el grupo sin dominancia la frecuencia de aneurismas fue mucho menor (3.9%)(Quintero-Oliveros y col., 2009).
La variante anatómica de configuraciones asimétricas en A1 probablemente facilita el desarrollo de aneurismas de Acoma por el flujo de tensiones, proporcionando más evidencia al papel de los factores biofísicos, sin embargo, los patrones de flujo en la ACoA son complejas, y su eventual influencia en el desarrollo de los aneurismas no se ha investigado a fondo (Ujiie 1996).
Clasificación
Localización
Se encuentran más comúnmente en la intersección de la A1-A2 del lado dominante.
El ángulo de las arterias en la bifurcación y la dirección del flujo de la sangre son factores de estrés hemodinámico en la región apical donde estos aneurismas se suelen desarrollar.
Generalmente en la bifurcación de A1, A2 y Acoma dominante en dirección opuesta a la A1 dominante.
Son más propensos a la ruptura y presentan más morbilidad postoperatoria entre los aneurismas de la circulación anterior.
Clínica
Diagnóstico
TAC
En casi todos los casos existe sangre en la fisura interhemisférica (En un 63 % de casos un hematoma intracerebral. En un 79 % irrupción intraventricular. En un 25 % hidrocefalia).
Angio-TAC
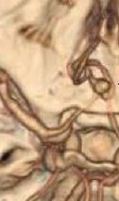
Angiografía cerebral
Es preciso una evaluación preoperatoria adecuada y comprensión de la anatomía tridimensional del aneurisma para la planificación preoperatoria adecuada y la selección del tipo de tratamiento (Sano 2010).
1.En el caso en que el aneurisma se rellene solo por un lado se efectuará una compresión de la carótida del lado por el que se rellena el aneurisma mientras se inyecta contraste por la carótida que no rellenaba el aneurisma.(Serie con compresión).
2.Valorar si cada carótida rellena ambas cerebrales anteriores (permite la decisión de un trapping en caso necesario).
3.En caso de necesidad de mejor visualización se requerirán tomas oblicuas de 25º centradas a 3 cm por encima de la pared lateral de la órbita ipsilateral y el tubo de Rx en proyección de TOWNE.
Tratamiento
Pronóstico
Históricamente se ha observado que tienen peores resultados neuropsicológicos.
Los no rotos tienen una alta probabilidad de ruptura, especialmente los de cúpula con proyección anterior, la presencia de una ampolla, y un tamaño de ≥ 5 mm 1).
Bibliografía
Agrawal, A, Y Kato, L Chen, K Karagiozov, M Yoneda, S Imizu, H Sano, y T Kanno. 2008. Anterior communicating artery aneurysms: an overview. Minimally Invasive Neurosurgery: MIN 51, no. 3 (Junio): 131-135. doi:10.1055/s-2008-1073169.
Andaluz N, van Loveren HR, Keller JT, Zucarello M: Anatomic and clinical study of the orbitopterional approach to anterior communicating artery aneurysms. Neurosurgery 52:1140–1149, 2003.
Andrews RJ, Spiegel PK. Intracranial aneurysms: characteristics of aneurysms by site, with special reference to anterior communicating aneurysms. Surg Neurol. 1981;16:122-126.[Medline] [Order article via Infotrieve]
Bhatoe, Harjinder S. 2009. Transciliary supraorbital keyhole approach in the management of aneurysms of anterior circulation: Operative nuances. Neurology India 57, no. 5 (Octubre): 599-606. doi:10.4103/0028-3886.57812.
Birknes, John K, Sung-Kyun Hwang, Aditya S Pandey, Kevin Cockroft, Anne-Marie Dyer, Ronald P Benitez, Erol Veznedaroglu, y Robert H Rosenwasser. 2006. Feasibility and limitations of endovascular coil embolization of anterior communicating artery aneurysms: morphological considerations. Neurosurgery 59, no. 1 (Julio): 43-52; discussion 43-52. doi:10.1227/01.NEU.0000219220.25721.B9.
Cardali S, Romano A, Angileri FF, Conti A, La Torre D, de Divitiis O, d’Avella D, Tschabitscher M, Tomasello F: Microsurgical anatomic features of the olfactory nerve: Relevance to olfaction preservation in the pterional approach. Neurosurgery 57 [1 Suppl]:17–21, 2005.
Cavalcanti DD, García-González U, Agrawal A, Crawford NR, Tavares PL, Spetzler RF, Preul MC. Quantitative anatomic study of the transciliary supraorbital approach: benefits of additional orbital osteotomy? Neurosurgery. 2010 Jun;66(6 Suppl Operative):205-10.
Figueiredo EG, Deshmukh V, Nakaji P, Deshmukh P, Crusius MU, Crawford N, Spetzler RF, Preul MC: An anatomical evaluation of the mini-supraorbital approach and comparison with standard craniotomies. Neurosurgery 59 [Suppl 2]:ONS212–ONS220, 2006.
Figueiredo EG, Deshmukh P, Zabramski JM, Preul MC, Crawford N, Spetzler RF: The pterional-transsylvian approach: An analytical study. Neurosurgery 59 [Suppl 2]:ONS263–ONS269, 2006.
Figueiredo EG, Deshmukh P, Zabramski JM, Preul MC, Crawford NR,Siwunawatn R, Spetzler RF: Quantitative anatomic study of three surgical approaches to the anterior communicating artery complex. Neurosurgery 56:397–405, 2005.
Filipce, Venko, Promod Pillai, Orphee Makiese, Hekmat Zarzour, Matt Pigott, y Mario Ammirati. 2009. Quantitative and qualitative analysis of the working area obtained by endoscope and microscope in various approaches to the anterior communicating artery complex using computed tomography-based frameless stereotaxy: a cadaver study. Neurosurgery 65, no. 6 (Diciembre): 1147-1152; discussion 1152-1153. doi:10.1227/01.NEU.0000359328.90826.97.
Fouché, C.H., 1931. Aneurysm of the Anterior Communicating Artery of the Brain. Proceedings of the Royal Society of Medicine, 24(11), págs.1471-1472.
Hernesniemi J, Dashti R, Lehecka M, Niemelä M, Rinne J, Lehto H, Ronkainen A,Koivisto T, Jääskeläinen JE. Microneurosurgical management of anterior communicating artery aneurysms. Surg Neurol. 2008 Jul;70(1):8-28; discussion 29.
HUBER, P.J. & STEARNS, A.B., 1954. The bi-frontal approach for aneurysm of anterior communicating artery: case report using hypotensive anesthesia. Harper Hospital Bulletin, 12(2), págs.50-54.
Hyun SJ, Hong SC, Kim JS. Side selection of the pterional approach for superiorly projecting anterior communicating artery aneurysms. J Clin Neurosci.2010 May;17(5):592-6.
Inci S, Ozgen T. Multiple aneurysms of the anterior communicating artery: radiological and surgical difficulties. J Neurosurg. 2005 Mar;102(3):495-502.
Kalavakonda C, Sekhar LN, Ramachandran P, Hechl P: Endoscope-assisted microsurgery for intracranial aneurysms. Neurosurgery 51:1119–1127, 2002.
Kassam A, Horowitz M, Welch W, Sclabassi R, Carrau R, Snyderman C,Hirsch B: The role of endoscopic assisted microneurosurgery (image fusion technology) in the performance of neurosurgical procedures. Minim Invasive Neurosurg 48:191–196, 2005.
Kawashima, Masatou, Takao Kitahara, Kazui Soma, y Kiyotaka Fujii. 2009. An unusual variant of the ruptured anterior communicating artery aneurysm located on the planum sphenoidale. Neurology India 57, no. 6: 831. doi:10.4103/0028-3886.59501.
Kimura, Toshikazu, Kengo Nishimura, Syunsuke Fukaya, y Akio Morita. 2010. Fusiform aneurysm of the anterior communicating artery treated by vascular reconstruction: case report. Neurosurgery 66, no. 5 (Mayo): E1025-1026. doi:10.1227/01.NEU.0000367768.41781.CD.
Krammer MJ, Lumenta CB. The new aneurysm clip system for particularly complex aneurysm surgery: technical note. Neurosurgery. 2010 Jun;66(6 Suppl Operative):336-8.
Krayenbühl, H., L'aneurysme de l'arteree communicante anterieure, p. 42, p. 110, Masson & Cie., Paris, 1959
Lan Q, Gong Z, Kang D, Zhang H, Qian Z, Chen J, Huang Q: Microsurgical experience with keyhole operations on intracranial aneurysms. Surg Neurol 66 [Suppl 1]:S2–S9, 2006.
Lownie, S P, C G Drake, S J Peerless, G G Ferguson, y D M Pelz. 2000. Clinical presentation and management of giant anterior communicating artery region aneurysms. Journal of Neurosurgery 92, no. 2 (Febrero): 267-277. doi:10.3171/jns.2000.92.2.0267.
Moret J, Pierot L, Boulin A, Castaings L, Rey A: Endovascular treatment of anterior communicating artery aneurysms using Guglielmi detachable coils. Neuroradiology 38:800–805, 1996.
Mori, K, T Yamamoto, Y Nakao, K Oyama, T Esaki, M Watanabe, S Nonaka, T Hara, y K Honma. 2008. Lateral supraorbital keyhole approach to clip unruptured anterior communicating artery aneurysms. Minimally Invasive Neurosurgery: MIN 51, no. 5 (Octubre): 292-297. doi:10.1055/s-0028-1085422.
Paladino J, Mrak G, Miklic´ P, Jednacak H, Mihaljevic´ D: The keyhole concept in aneurysm surgery—A comparative study: Keyhole versus standard craniotomy. Minim Invasive Neurosurg 48:251–258, 2005.
Profeta G, De Falco R, Ambrosio G, Profeta L: Endoscope-assisted microneurosurgery for anterior circulation aneurysms using the angle-type rigid endoscope over a 3-year period. Childs Nerv Syst 20:811–815, 2004.
Quintero-Oliveros, S.T. et al., 2009. [Morphological characteristics of cerebral aneurysm of Willis’ circle: a direct anatomical study]. Neurocirugía (Asturias, Spain), 20(2), págs.110-116.
Sano H. Treatment of complex intracranial aneurysms of anterior circulation using multiple clips. Acta Neurochir Suppl. 2010;107:27-31.
Sekhar LN, Natarajan SK, Britz GW, Ghodke B: Microsurgical management of anterior communicating artery aneurysms. Neurosurgery 61 [Suppl 2]:273– 292, 2007.
Tönnis W. Erfolgreiche Behandlung eines Aneurysma der Art.comm.ant. cerebri. Zbl.Neurochir. 1:39-42, 1936
Ujiie, H., Dieter W. Liepsch, Max Goetz, R. Yamaguchi, H. Yonetani, K. Takakura, y R. Loch Macdonald. 1996. Hemodynamic Study of the Anterior Communicating Artery. Stroke 27, no. 11 (Noviembre 1): 2086-2094.
Umredkar, Alok A, Navneet Singla, y Singla K Gupta. 2009. Ruptured anterior communicating artery aneurysm presenting with monocular blindness. Neurology India 57, no. 6 (Diciembre): 826-828. doi:10.4103/0028-3886.59498.
Yasargil MG (1984) Anterior cerebral and anterior communicating artery aneurysms. In: Yasargil MG (ed) Microneurosurgery vol II. Clinical considerations, surgery of the intracranial aneurysms and results. Thieme, New York, pp 165–231
(5) Use of oxycellulose Tabotamp insertion technique between the aneurysm neck and neighbouring perforators to avoid inclusion of the latter (“Mitklippen”) at the time of neck clipping. (6) Double clipping method at the time of incomplete neck clipping due to athromatous plaque. Combination of fenestrated clip and standard clip or “puncture and collapse” method at the time of aneurysm incorporation of parent and/or branching arteries. (7) Use of microDoppler to confirm patency of the parent arteries and their branches. For doing surgery of aneurysms of main cerebral arteries following points are discussed: (1) AcomA aneurysms; (a) Aneurysms located lower than 1.5 cm above the level of the anterior clinoid process in the lateral view on digital subtraction angiography DSA can be managed with conventional pterional approach. (b) Usually from the right side (non dominant hemisphere) but in the following situations from the left side: hematoma on the left side, concomitant unruptured aneurysms on the left side, left A1 dominancy at the acute stage of SAH and its dissection is considered to be difficult from the right side. © Always rectal gyrus approach to the aneurysm with any direction. This also enables safety subpial approximation “subpiale Annaeherung” to aneurysms. (d) No use of coagulation as much as possible. (2) ICA aneurysms; (a) Performance of selective extradural anterior clinoidectomy SEAC for paraclinoid aneurysms not only for aneurysm dissection but for proximal control. (b) Neither sacrifice nor Mitklippen of the posterior communicating artery at the time of ICA-PcomA aneurysms, not only for the prevention of the PCA infarction in case of its embryonal type but also for the prevention of tuberothalamic infarction due to compromise of the anterior thalamoperforating arteries originating from the PcomA. © Dissecting aneurysms of the ICA: difficulties of diagnosis or differentiation from paraclinoid anurysms. Difficulties of optimal direct clipping and resort to trapping or proximal ligation plus bypass. Its predilection site is at the medial anterior wall of the C1 portion but may occur also in any other portion of the ICA. (3) Middle cerebral artery MCA aneurysms; (a) For dissection, superior temporal gyrus ablation is not necessary but opening of the Sylvian fissure by retrograde tracing of a cortical artery on the surface of the temporal lobe. This cortical artery can be used as recipient when a bypass surgery turns out to be necessary with the use of a donor artery from the frontal branch of the STA. (b) Importance of interpreting DSA or 3DCT angiography in regard to whether the aneurysm dome is outside (lateral) or inside (medial) of the MCA bifurcation. This helps in anticipating whether the aneurysm dome or MCA branches come into view first at the time of intraSylvian dissection. © In case of presence of aneurysms at the contralateral MCA, accessibility from the ipsilateral side depends on the distance form the midline (for example early bifurcation), the relationship to the sphenoid wing (not below the level of the sphenoid wing) and no strong Sylvian vein darining into the sphenoparietal sinus being in the way.
Han ocupado más de la mitad de los aneurismas rotos del International Subarachnoid Aneurysm Trial (ISAT).
Casos
3505