Tractografía
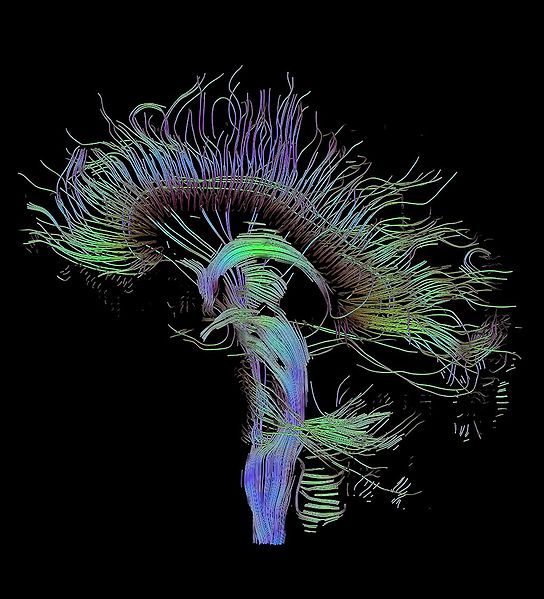 La tractografía es la representación 3D de las imágenes de resonancia obtenidas mediante imágenes con tensor de difusión o Imagen Ponderada por Difusión“, que se usa para poner de manifiesto los tractos neurales de sustancia blanca en el interior o alrededor de una lesión, proporcinando una información importante en la planificación de la resección de una lesión cerebral.
La tractografía es la representación 3D de las imágenes de resonancia obtenidas mediante imágenes con tensor de difusión o Imagen Ponderada por Difusión“, que se usa para poner de manifiesto los tractos neurales de sustancia blanca en el interior o alrededor de una lesión, proporcinando una información importante en la planificación de la resección de una lesión cerebral.
Utiliza técnicas especiales de imagen por resonancia magnética (RM) y análisis de imágenes asistido por ordenador. El resultado se presenta en imágenes bi y tridimensionales.
Tractos de especial interés
Además de los largos tractos que conectan el cerebro con el resto del cuerpo, existe una complicada red tridimensional formada por conexiones a corta distancia entre las diferentes áreas corticales y subcorticales del encéfalo. La existencia de estos haces había sido puesta de manifiesto mediante técnicas biológicas y de histoquímica en especímenes post-mortem. Los tractos cerebrales no son identificables por examen directo o por exploraciones mediante tomografía computarizada o IRM. Esta dificultad explica lo pobre de su descripción en los atlas de neuroanatomía y lo escasamente comprendido de sus funciones.
Las secuencias que se utilizan en la IRM observan la simetría de la difusión del agua en el cerebro. Los haces de tractos de fibras hacen que el agua se difunda asimétricamente en un tensor siendo el eje mayor paralelo a la dirección de las fibras. A esta asimetría se la conoce como anisotropía. Se da una relación directa entre el número de fibras y el grado de anisotropía.
Técnica de IRM
La tractografía se lleva a cabo utilizando una técnica de RM conocida como “Imagen Ponderada por Difusión”, que es sensible a la difusión del agua en el cuerpo de forma que se puede utilizar para mostrar su imagen tridimensonal. La difusión libre del agua tiene lugar en estas condiciones en todas las direcciones posibles. A esto se le llama difusión “isotrópica”. Si el agua difunde en un medio con barreras, la difusión deja de ser uniforme, pasando a ser “anisotrópica”. En tal caso, la movilidad relativa de las moléculas a partir del origen tendrá una forma distinta de la esfera. En ocasiones, esta forma se modeliza como un elipsoide, y a esta técnica se la denomina imagen con tensores de difusión.
Muchas cosas pueden actuar como barrera: membranas celulares, axones, mielina, etc; pero en la sustancia blanca la principal barrera es la vaina de mielina de los axones. Éstos oponen una barrera a la difusión perpendicular y una ruta para la difusión paralela en el sentido de la orientación de las fibras.
Se espera que la difusión anisotrópica se incremente en áreas axonales maduras altamente ordenadas. En las afecciones en las que se distorsiona la mielina o la estructura de los axones, como en traumatismos físicos, tumores e inflamaciones reducen la isotropía, ya que las barreras a la difusión quedan afectadas por destrucción o desorganización.
La anisotropía se puede medir de múltiples formas: Una de ellas mediante una proporción llamada “anisotropía fraccional” (FA). Una anisotropía de “0” corresponde con una esfera perfecta, mientras que 1 sería una difusión lineal ideal. Los tractos bien definidos tienen una FA mayor que 0,2. Hay pocas regiones con una FA mayor de 0,9. La cifra nos proporciona información de la esfericidad de la difusión, pero no aporta nada sobre su dirección. Each anisotropy is linked to an orientation of the predominant axis (predominant direction of the diffusion). Post-processing programs are able to extract this directional information.
Esta información adicional es difícil de representar en imágenes 2D en escala de grises. Para solucionar este problema se ha añadido un código de colores. Los colores básicos pueden informar al observador de la orientación de las fibras en un sistema de coordenadas tridimensionales. A este tipo de representaciones se las conoce como “mapas anisotrópicos”. El software puede codificar los colores de este modo:
El rojo indica direcciones en el eje X. El verde indica direcciones en el eje Y. El azul indica direcciones en el eje Z.
Adviértase que la técnica no puede discriminar direcciones “positivas” o “negativas” dentro del mismo eje.
La presencia de infiltracion o desplazamiento de la vía piramidal o el fasciculo longitudinal inferior fue predictivo de una menor probabilidad de resección total, especialmente para los tumores con un volumen preoperatorio <100 cm cubicos. concluyendo que este método de resonancia DTI puede ser considerado como una herramienta prometedora para la estimación preoperatoria del grado de radicalidad quirúrgica que se conseguirá (Castellano y col., 2011).
Indicaciones
Es eficaz, pero no del todo fiable en la delineación de las vías motoras descendentes. La integración de la estimulación cortical favorece de forma específica la cirugía del glioma cerebral en áreas elocuentes (Zhu y col., 2012).
Problemas de la tractografía convencional
Está asociado con restricciones en la resolución en fibras que se cruzan o besan así como en la vecindad del tumor o edema.
Al principio del desarrollo de tractografía DTI, un gran número de investigadores señalaron un error en el modelo tensor de difusión. El análisis tensor asume que existe un elipsoide sola imagen en cada voxel como si todos los axones que viajan a través de un voxel viajó en exactamente la misma dirección. Esto sucede a menudo, pero se puede estimar que en más del 30% de los vóxeles en una imagen de resolución cerebro estándar, hay al menos dos zonas diferentes neurales que viajan en direcciones diferentes que pasan a través de la otra. En el modelo clásico de difusión elipsoide tensor, la información desde el tracto cruzar sólo aparece como ruido o anisotropía inexplicable disminuyó en un voxel dado. David Tuch fue uno de los primeros en describir una solución viable a este problema
Bibliografía
Castellano, Antonella, Lorenzo Bello, Caterina Michelozzi, Marcello Gallucci, Enrica Fava, Antonella Iadanza, Marco Riva, Giuseppe Casaceli, y Andrea Falini. 2011. «Role of diffusion tensor magnetic resonance tractography in predicting the extent of resection in glioma surgery». Neuro-Oncology (Octubre 20). doi:10.1093/neuonc/nor188. http://www.ncbi.nlm.nih.gov/pubmed/22015596.
Zhu, Feng-Ping, Jin-Song Wu, Yan-Yan Song, Cheng-Jun Yao, Dong-Xiao Zhuang, Geng Xu, Wei-Jun Tang, Zhi-Yong Qin, Ying Mao, and Liang-Fu Zhou. 2012. “Clinical Application of Motor Pathway Mapping Using Diffusion Tensor Imaging Tractography and Intraoperative Direct Subcortical Stimulation in Cerebral Glioma Surgery: A Prospective Cohort Study.” Neurosurgery (September 24). doi:10.1227/NEU.0b013e318271bc61.