Meningioma del surco olfatorio
La primera publicación de este meningioma intracraneal se atribuye a Francis en 1895 1).
La característica de lento crecimiento y la amplitud de la fosa craneal anterior contribuye a que este meningioma intracraneal alcance un gran tamaño. 2) 3).
Localización
El meningioma tiene origen en la lámina cribosa o sutura frontoesfenoidal, de localización medial pero pueden predominar hacia un lado (Rubin y col., 1994).
Extensión
La extensión a seno etmoidal se presenta aproximadamente en el 15 % de los casos, pudiendo representar estos un área importante de colaboración entre neurocirugía y otorrinolaringología ya que un abordaje subcraneal ofrece un excelente acceso quirúrgico para la extirpación, en particular para las recurrencias que involucran los senos paranasales y región orbitaria (Pepper y col., 2011).
Epidemiología
10-15 % de todos los meningiomas 4) 5).
Más frecuente entre mujeres de 50-60 años.
En la serie de Ciurea, la edad promedio de presentación fue de 52 años (edad: 20-76 años) y la proporción de sexos fue 1.45:1 (mujeres / hombres) (Ciurea y col., 2011).
Clínica
La compresión de los lóbulos frontales puede generar alteración de la personalidad, cambios de conducta que pueden demorar el diagnóstico al orientar el mismo hacia la patología psiquiátrica o psicológica.
Puede dar lugar al síndrome de Foster-Kennedy
Anosmia
Aunque se asocia con este tipo de meningiomas, rara vez debutan con este síntoma (Ojemann 1991).
Los principales síntomas asociados a este tumor son la anosmia y la cefalea que, inicialmente, pueden confundirnos con otras patologías como la sinusitis frontal, la migraña y las neuralgias. La confusión suele originar un retraso en el diagnóstico, por lo que el tamaño de los meningiomas suele ser apreciable en el momento de su descubrimiento por pruebas de imagen.
Alteraciones visuales
El déficit campimétrico suele ser inferior por la compresión superior del tumor (Ali y col., 2009).
Diagnóstico
El diagnóstico inicial se basa en la historia clínica apoyada por pruebas de imagen, siendo las más útiles la TAC y la RM cerebral.
Los meningiomas son tumores muy vascularizados con captación de contraste (p.ej. gadolinio) y con calcificaciones frecuentes.
En RM el quiasma y el nervio óptico suelen aparecer desplazados en sentido ínferolateral.
El tamaño en el momento del diagnóstico varía significativamente. En la serie de Ciurea y col varía entre 2 y 11 cm (Ciurea y col., 2011).
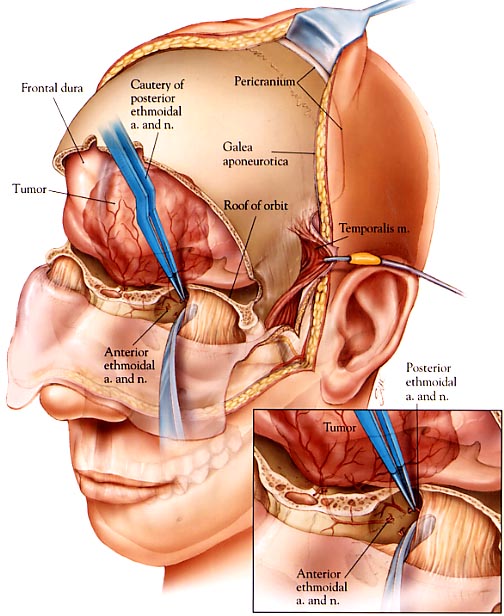
En la angiografía cerebral se suele apreciar irrigación por las arterias etmoidal anteriores y posteriores, de los ramas anteriores de la arteria meníngea media, y de los ramas meníngeas de la arteria oftálmica.
En algunos tumores grandes además ramas pequeñas de la arteria cerebral anterior y de la comunicante anterior.
Suelen desplazar la arteria cerebral anterior en sentido ´posterosuperior.
Diagnóstico diferencial
Debe realizarse diagnóstico diferencial con los carcinomas (incluidas las metástasis), angiofibromas, melanomas, paragangliomas, fibromas osificantes psamomatosos, ganglioglioma…en cuyo caso las secuencias de RM de difusión, perfusión y espectroscopia puede ser de gran ayuda (Menon y col., 2009).
Las mayores dudas las plantea el meningioma del tuberculum sellae (en este caso el quiasma y el nervio óptico son desplazados en sentido súperolateral y el nervio olfatorio en sentido inferior).
Tratamiento
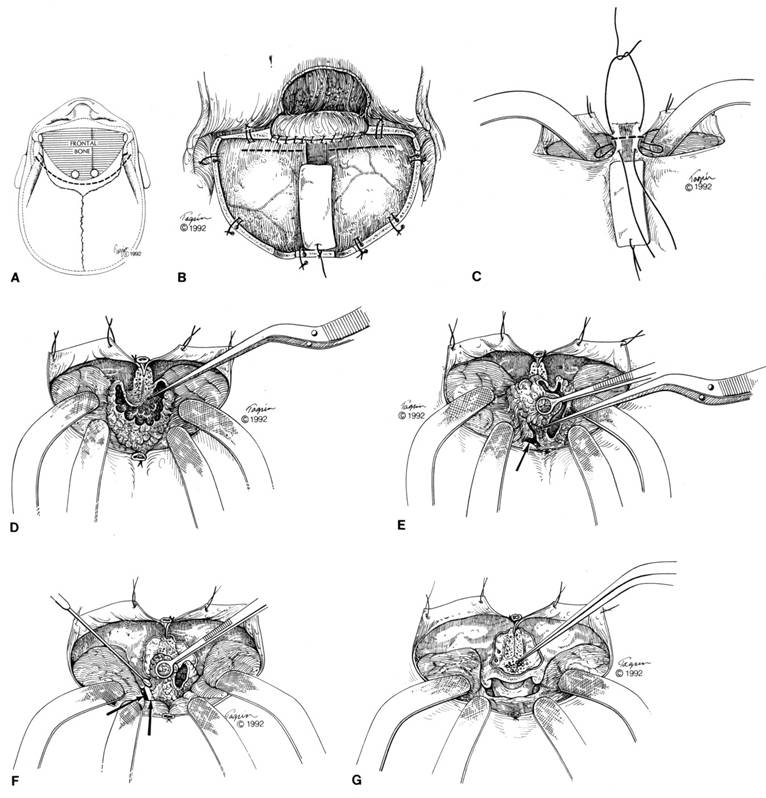
Desde que Francesco Durante interviniese el primer meningioma del surco olfatorio en el año 1885, a través de una craneotomía frontal izquierda (Bassiouni y col., 2007; Cushing y Eisenhardt, 1938) muchos son los abordajes que se han empleado (unilateral frontal, bifrontal,pterional, abordajes frontoorbitonasales, osteotomías orbitarias y sus combinaciones).
La superioridad definida de una técnica quirúrgica sobre otros no ha sido demostrada y muchos neurocirujanos prefieren utilizar abordajes bifrontales o unifrontales dependiendo del tamaño del tumor.
El objetivo es la interrupción temprana de la irrigación tumoral, la separación atraumática de los lóbulos frontales, la exposición y disección de las arterias cerebrales anteriores, nervios ópticos y quiasma y excelente visualización de la fosa craneal anterior para posible reparación de defectos (Hassler y Zentner 1989).
Las vías de abordaje más utilizadas son la subfrontal uni o bilateral y la pterional.
Subfrontal
Permite la desvascularización por acceso a las arterias etmoidales. Permite reparar mejor la base de cráneo.
Vía Pterional
Visualización temprana del óptico y arterias cerebrales anteriores.
Menor retracción del lóbulo frontal. Evita la entrada al seno frontal.
Nakamura y col., a través de un abordaje frontolateral, y una craneotomía de 2 x 2,5 cm., entre el borde lateral del seno frontal y botón orbitario, abrieron la cisura de Silvio para drenar el LCR y así retraer mínimamente el lóbulo frontal. Consiguieron la extirpación de tumores grandes de hasta 8 cm en la dimensión más larga, sin ninguna complicación grave (Nakamura y col., 2007).
Transglabelar/subcranial
Interhemisférico
HENTSCHEL (Bifrontal y biorbitaria), propone una vía para coagular la arteria etmoidal en la siguiente figura:
En los casos en que exista invasión orbitaria y de senos paranasales, se puede utilizar un abordaje cráneofacial, que incluye una craneotomía frontal o bifrontal combinado con osteotomía orbitaria y nasal.
Abordaje endonasal ampliado (Fernandez-Miranda y col., 2009).
Abordaje endoscópico endonasal transetmoidal (Kim y col., 2011).
Tras la extirpación se debe examinar siempre la lámina cribosa extirpando y cauterizando con curetas, para prevención de la recurrencia, lo cual se puede lograr con cualquier vía de abordaje.
Las opciones alternativas al tratamiento quirúrgico se utilizan principalmente en pacientes que no son candidatos para cirugía o cuya localización o recurrencia la contraindican.
Las opciones incluyen radioterapia, radiocirugía estereotáctica y quimioterapia (Adappa y col., 2011).
Hoja operatoria
Bajo anestesia general, intubación orotraqueal y profilaxis antibiótica con vancomicina 1 gr.IV.
Colocación del paciente en decúbito supino sobre cabezal de Mayfield® en posición neutra.
Antisepsia cutánea con Povidona yodada al 10 %.
Incisión cutánea bicoronal.
Disección hasta exponer el área para la craneotomía.
Craneotomía bifrontal con ayuda de 4 trépanos.
Se identifica apertura al seno frontal que se esqueletiza y se rellena con Mimix.
Apertura dural semicircular bilateral y se liga el seno longitudinal en la región más anterior.
Se identifica interhemisfericamente a nivel anterior tejido de aspecto grisaceo anclado a nivel de cresta Galli.
Se diseca y se coagulan adherencias a nivel de plano etmoidal y esfenoidal. Se realiza de forma progresiva vaciamiento intracapsular del meningioma con ayuda de aspirador ultrasónico.
Se identifica en el lecho del meningioma tejido calcificado.
Aceptable plano de clibaje a nivel lateral y posterior. Exéresis Simpson Grado I. Hemostasia de lecho quirúrgico.
Se tapiza la zona del plano etmoidal con Duraseal y Duragen.
Sutura de duramadre con Vicryl de 3 “0”. Sobre regón de cresta frontal y cresta Galli extraduralmente se coloca colgado pericraneal pediculado. Puntos de pexia epidurales. Se coloca craneoplastia con 3 miniplacas Subcutáneo con Vicryl. Piel con grapas. Se remite para estudio histopatológico componente blando y óseo del meningioma.
Pronóstico
Los tumores mayores de 3 cm son más difíciles de tratar por su relación con estructuras vásculonerviosas.
No todos los pares craneales tienen el mismo rango, es decir, la pérdida de función del nervio olfatorio no determina tanto el resultado funcional como un nervio óptico.
Las recidivas tumorales no son infrecuentes, especialmente en el caso de masas voluminosas o con extensión extracraneal en las que es difícil la exéresis completa del meningioma.
En caso de restos es conveniente el uso de radioterapia postquirúrgica para intentar reducir las recurrencias o recidivas.
En el primer mes tras la cirugía, se aprecia una mejora de la agudeza visual y del déficit del campo visual.
También las funciones mentales superiores muestran una mejoría.
Una investigación sistemática a largo plazo de los resultados tras un tratamiento microquirúrgico con respecto a la función olfativa y mental, rara vez se ha realizado, pero se debería intentar preservar el olfato en pacientes con función normalizada o reducida (Bassiouni y col., 2007).
Complicaciones
La complicación más frecuente es la rinorrea (Gazzeri y col., 2008).
Bibliografía
Ali, N, M Akunjee, y F Ahfat. 2009. Acute and severe visual loss due to an olfactory groove meningioma. Canadian Journal of Ophthalmology. Journal Canadien D’ophtalmologie 44, no. 5 (Octubre): e49-50.
Bassiouni, H, S Asgari, and D Stolke. 2007. “Olfactory Groove Meningiomas: Functional Outcome in a Series Treated Microsurgically.” Acta Neurochirurgica 149 (2) (February): 109–121; discussion 121. doi:10.1007/s00701-006-1075-z.
Ciurea, A.V. et al., 2011. Olfactory groove meningiomas : A retrospective study on 59 surgical cases. Neurosurgical Review. Available at: http://www.ncbi.nlm.nih.gov/pubmed/21960302
Cushing H, Eisenhardt L: The olfactory meningiomas with primary anosmia, in Cushing H, Eisenhardt L (eds): Meningiomas. Springfield: Charles C. Thomas, 1938: 250–282, 1938
Fernandez-Miranda, J C, P A Gardner, D M Prevedello, y A B Kassam. 2009. Expanded endonasal approach for olfactory groove meningioma. Acta Neurochirurgica 151, no. 3 (Marzo): 287-288; author reply 289-290. doi:10.1007/s00701-009-0201-0.
Gazzeri, Roberto, Marcelo Galarza, y Giovanni Gazzeri. 2008. Giant olfactory groove meningioma: ophthalmological and cognitive outcome after bifrontal microsurgical approach. Acta Neurochirurgica 150, no. 11 (Noviembre): 1117-1125; discussion 1126. doi:10.1007/s00701-008-0142-z.
Kim, Y H, D H Han, C-K Park, C H Lee, and D G Kim. 2011. “An Endoscopic Endonsal Transethmoidal Approach to Olfactory Groove Meningioma.” Central European Neurosurgery 72 (4) (November): 205–208. doi:10.1055/s-0031-1291179.
Hassler W, Zentner J: Pterional approach for surgical treatment of olfactory groove meningiomas. Neurosurgery 1989;25:942-947
Menon, G, S N Patro, K Krishnakumar, C Kesavadas, S Nair, y V V Radhakrishnan. 2009. Subfrontal gangliocytoma masquerading as olfactory groove meningioma. British Journal of Neurosurgery 23, no. 1 (Febrero): 79-82. doi:10.1080/02688690802308695.
Nakamura M, Struck M, Roser F, Vorkapic P, Samii M: Olfactory groove meningiomas: Clinical outcome and recurrence rates after tumor removal throught the frontolateral and bifrontal approach. Neurosurgery 60: 844–852, 2007
Ojemann RG: Olfactory groove meningiomas, in Al-Mefty O (ed): Meningiomas. New York: Raven Press, 1991, pp383–393
Pepper, Jon-Paul, Sarah L Hecht, Stephen S Gebarski, Erin M Lin, Stephen E Sullivan, and Lawrence J Marentette. 2011. “Olfactory Groove Meningioma: Discussion of Clinical Presentation and Surgical Outcomes Following Excision via the Subcranial Approach.” The Laryngoscope 121 (11) (November): 2282–2289. doi:10.1002/lary.22174.
Rubin G, Ben David U, Gornish M, Rappaport ZH: Meningioma of the anterior cranial fossa floor. Acta Neurochir (Wien) 1994; 129:26-30
Bibliografía recomendada
1. Al-Mefty O: Operative Atlas of Meningiomas. Philadelphia:Lippincott-Raven, 1998, pp 1–66
2. Babu R, Barton A, Kasoff SS: Resection of olfactory groovemeningiomas: technical note revisited. Surg Neurol 44:567–572, 1995
3. Black PM: Meningiomas. Neurosurgery 32:643–657, 1993
4. DeMonte F: Surgical treatment of anterior basal meningiomas.J Neurooncol 29:239–248, 1996
5. DeMonte F, Marmor E, Al-Mefty O: Meningiomas, in KayeA, Laws E Jr. (eds): Brain Tumors: An Encyclopedic Approach,ed 2. London: Churchill Livingstone, 2001, pp719–750
6. Derome PJ, Guiot G: Bone problems in meningiomas invadingthe base of the skull. Clin Neurosurg 25:435–451, 1978
7. El Gindi S: Olfactory groove meningioma: surgical techniquesand pitfalls. Surg Neurol 54:415–417, 2000
8. Hassler W, Zentner J: Pterional approach for surgical treatmentof olfactory groove meningiomas. Neurosurgery 25:942–947,1989
9. Hassler W, Zentner J: Surgical treatment of olfactory groovemeningiomas using the pterional approach. Acta NeurochirSuppl 53:14–18, 1991
10. Ho DM, Hsu CY, Ting LT, et al: Histopathology and MIB-1labeling index predicted recurrence of meningiomas: a proposalof diagnostic criteria for patients with atypical meningioma.
Cancer 94:1538–1547, 2002
11. Jallo GI, Benjamin V: Tuberculum sellae meningiomas: microsurgicalanatomy and surgical technique. Neurosurgery 51:1432–1440, 2002
12. Jensen R, McCutcheon IE, DeMonte F: Postoperative swelling of pericranial pedicle graft producing intracranial mass effect.Report of two cases. J Neurosurg 91:124–127, 1999
13. Mayfrank L, Gilsbach JM: Interhemispheric approach for microsurgical removal of olfactory groove meningiomas. Br J Neurosurg 10:541–545, 1996
14. McDermott MW, Rootman J, Durity FA: Subperiosteal, subperiorbital dissection and division of the anterior and posterior ethmoid arteries for meningiomas of the cribriform plate
and planum sphenoidale: technical note. Neurosurgery 36:1215–1219, 1995
15. Mirimanoff RO, Dosoretz DE, Linggood RM, et al: Meningioma:analysis of recurrence and progression following neurosurgical resection. J Neurosurg 62:18–24, 1985
16. Ojemann RG: Olfactory groove meningiomas, in Al-Mefty O (ed): Meningiomas. New York: Raven Press, 1991, pp383–393
17. Paterniti S, Fiore P, Levita A, et al: Basal meningiomas. A retrospective study of 139 surgical cases. J Neurosurg Sci 43:107–114, 1999
18. Paterniti S, Fiore P, Levita A, et al: Venous saving in olfactory meningioma’s surgery. Clin Neurol Neurosurg 101:235–237,1999
19. Tsikoudas A, Martin-Hirsch DP: Olfactory groove meningiomas.Clin Otolaryngol 24:507–509, 1999
20. Turazzi S, Cristofori L, Gambin R, et al: The pterional approach for the microsurgical removal of olfactory groove meningiomas.Neurosurgery 45:821–826, 1999
21. Welge-Luessen A, Temmel A, Quint C, et al: Olfactory function in patients with olfactory groove meningioma. J Neurol Neurosurg Psychiatry 70:218–221, 2001
22. Zevgaridis D, Medele RJ, Muller A, et al: Meningiomas of the sellar region presenting with visual impairment: impact of various prognostic factors on surgical outcome in 62 patients. Acta Neurochir 143:471–476, 2001.
Casos
Q4086